4 médicaments Les médecins ne prescrire plus jamais

Lorsque vous contestez votre santé à un médecin, vous pourriez penser que vous êtes tous les deux les seules parties à faire des appels cruciaux sur votre bien-être. Mais la seconde où votre médecin sort un coussin de prescription, ce cercle de confiance se développe pour inclure des sociétés pharmaceutiques et des agences de réglementation. Malheureusement, comme nous le savons tous à partir de rappels de haut niveau dans les médicaments qui sont enlevés du marché, l'industrie pharmaceutique fait parfois des erreurs. Bien que tous les médicaments comportent des risques et des avantages sociaux, certains produits se sont avérés tout simplement trop dangereux à prendre, provoquant une mort évitable et irréversible, voire la mort.
Pendant ce temps, de nombreux médicaments ayant des effets secondaires graves restent sur le marché ou reviennent après un bref rappel. Il faut beaucoup de temps pour que les médicaments soient tirés des étagères de façon permanente mais cela se produit. Lisez la suite pour en savoir plus sur quatre médicaments que les médecins ne prescriront probablement plus jamais et pour entendre les histoires surprenantes de la raison pour laquelle ils ne sont plus prescrits.
Lisez ceci suivant: Les grandes pharmacies bloquent ce médicament quotidien commun.
1 vioxx pour l'arthrite

Vioxx est un inhibiteur de COX-2 qui était autrefois couramment utilisé pour traiter l'arthrite. Mais en 2004, le fabricant du médicament, Merck & Co., Si elle avait enlevé le marché lorsque la nouvelle a annoncé qu'elle avait été liée à 88 000 crises cardiaques entre 1999 et 2003-38 000. Au moment où il a été retiré du marché, il a été estimé que plus de 20 millions de patients avaient pris le médicament. En 2007, Merck a atteint un 4.85 milliards de dollars de règlement pour résoudre des milliers de poursuites - le plus grand règlement de drogue de l'histoire, selon NPR.
"Il y a certainement un besoin pour les inhibiteurs du COX-2, mais en fin de compte, ils étaient mal commercialisés par des sociétés pharmaceutiques aux médecins pour utiliser des doses plus élevées", explique William Soliman, PhD, BCMAS, fondateur et PDG du Conseil d'accréditation pour les affaires médicales (ACMA) et un cadre pharmaceutique qui a précédemment travaillé avec Merck. "À mon avis, cela a conduit à une partie du risque cardiovasculaire", explique Soliman Meilleure vie.
2 bextra pour soulagement de la douleur

Valdecoxib, marqué comme Bextra, est un médicament anti-inflammatoire non stéroïdal (AINS) qui était autrefois prescrit comme analgésique. Cependant, en 2005, les chercheurs ont appris que le médicament provoquait des complications cardiovasculaires graves et parfois mortelles telles que la crise cardiaque et les accidents vasculaires cérébraux. Rarement, Bextra s'est également révélé provoquer deux réactions cutanées potentiellement mortelles appelées syndrome de Stevens-Johnson et nécrolyse épidermique toxique.
Ayant déterminé que Bextra n'avait aucun avantage particulier sur des analgésiques similaires qui n'ont pas provoqué de complications aussi graves, la FDA s'est déplacée pour interrompre son utilisation.
3 Belviq pour la perte de poids

Lorcaserin, marquée comme Belviq ou Belviq XR, a été précédemment prescrite comme médicament de perte de poids après avoir été approuvé en 2012. Cependant, en 2020, la FDA a demandé aux médecins de cesser de prescrire la lorcaserine après qu'une étude a révélé un lien entre le médicament et le cancer. ae0fcc31ae342fd3a1346ebb1f342fcb
"Nous prenons cette action parce que nous pensons que les risques de Lorcaserin l'emportent sur ses avantages en fonction de notre examen terminé des résultats d'un essai clinique randomisé évaluant la sécurité", a écrit la FDA dans son annonce de rappel. "Les professionnels de la santé devraient cesser de prescrire et de dispenser Lorcaserin aux patients. Contactez les patients qui prennent actuellement de la lorcaserine, informez-les de la survenue accrue du cancer observé dans l'essai clinique et demandez-leur d'arrêter de prendre le médicament. Discutez des médicaments ou des stratégies alternatifs de perte de poids avec vos patients "," L'organisme de réglementation a conseillé.
Pour plus d'informations sur la santé envoyées directement dans votre boîte de réception, inscrivez-vous à notre newsletter quotidien.
4 Raptiva pour le psoriasis
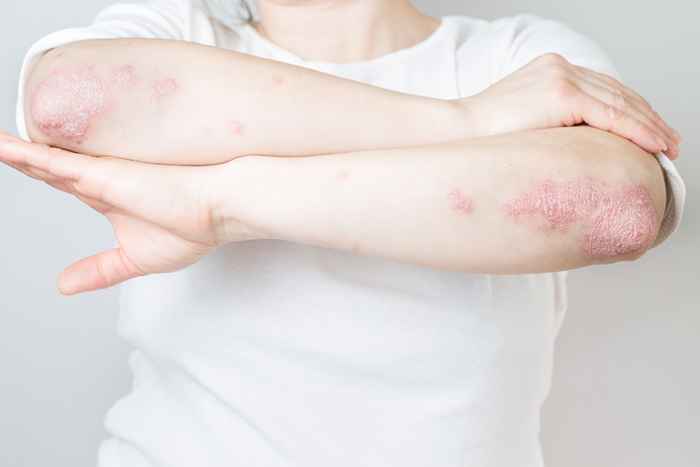
L'éfalizumab, marqué comme Raptiva, était un médicament injectable une fois par semaine utilisé pour traiter les adultes atteints de psoriasis de plaque modéré à sévère. Cependant, en 2009, son producteur a lancé "un retrait volontaire et progressif du produit du U.S. marché."
En effet. Dans son avis de retrait de drogue, la FDA a noté qu'il n'y a "aucun traitement efficace connu pour la LMP", et bien qu'il soit peu probable pour toute personne prenant Raptiva pour développer la maladie, il peut finalement être fatal chez ceux qui le contractent.
Best Life offre les informations les plus récentes des experts de haut niveau, de nouvelles recherches et des agences de santé, mais notre contenu n'est pas censé remplacer les conseils professionnels. En ce qui concerne le médicament que vous prenez ou toute autre question de santé que vous avez, consultez toujours votre fournisseur de soins de santé directement.


